Stokiometri
Stoikiometri adalah dasar perhitungan kimia yang menyatakan relasi kuantitatif rumus kimia
dan persamaan kimia. Berikut ini materi yang perlu kamu ketahui untuk
memahaminya, mulai dari konsep mol dan massa molar, rumus empiris dan
rumus molekular, dasar stoikiometri larutan dan gas ideal, dan penulisan
dan penyetaraan reaksinya, disertai contoh soal dan pembahasannya.
Massa molar, }, didefinisikan sebagai massa dari 1 mol entitas (atom, ion, molekul, unit formula) dari materi. Satuan dari massa molar (}) adalah gram/mol.
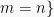

 Materi Stoikiometri: Hubungan massa, jumlah mol, dan jumlah atom dari unsur
Materi Stoikiometri: Hubungan massa, jumlah mol, dan jumlah atom dari unsur
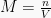
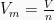 Hukum Avogadro menyatakan bahwa pada tekanan dan temperatur tertentu
dan tetap, volum gas secara langsung berbanding lurus terhadap jumlah
gas.
Hukum Avogadro menyatakan bahwa pada tekanan dan temperatur tertentu
dan tetap, volum gas secara langsung berbanding lurus terhadap jumlah
gas.
![V \infty n [P, T \: konstan] V \infty n [P, T \: konstan]](https://s0.wp.com/latex.php?latex=V+%5Cinfty+n+%5BP%2C+T+%5C%3A+konstan%5D&bg=f9f9f9&fg=000000&s=0)
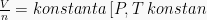
![V_m = konstanta \: [P, T \: konstan] V_m = konstanta \: [P, T \: konstan]](https://s0.wp.com/latex.php?latex=V_m+%3D+konstanta+%5C%3A+%5BP%2C+T+%5C%3A+konstan%5D&bg=f9f9f9&fg=000000&s=0) Pada keadaan STP (P = 1 atm, T = 273 K), Vm gas ideal = 22,414 L/mol
Pada keadaan STP (P = 1 atm, T = 273 K), Vm gas ideal = 22,414 L/mol
Pada keadaan RTP/ATP (P = 1 atm, T = 298 K), Vm gas ideal = 24 L/mol
Pada keadaan tertentu, berlaku hukum gas ideal:
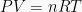
 di mana R adalah tetapan gas, R = 0,08206 L∙atm/mol∙K = 8,314 J/mol∙K
di mana R adalah tetapan gas, R = 0,08206 L∙atm/mol∙K = 8,314 J/mol∙K
Dalam persamaan reaksi, dikenal koefisien reaksi, yaitu bilangan yang berada di sebelah kiri rumus molekuler untuk mengalikan semua atom dalam rumus molekuler tersebut. Perbandingan koefisien-koefisien reaksi dapat diinterpretasi sebagai perbandingan mol zat-zat dalam reaksi. Pada setiap reaktan dan produk, dituliskan wujud zatnya (s (padat), l (cair), g (gas), atau aq (larutan dengan pelarut air)) dalam tanda kurung di sebelah kanan rumus molekuler masing-masing.
Contoh persamaan reaksi kimia setara:

Contoh langkah-langkah menyetarakan persamaan reaksi:
1.
2.
3.
4.
Jawab:

Konsep Mol dan Massa Molar (})
Dalam sistem SI, satu mol didefinisikan sebagai jumlah dari materi yang terdiri dari entitas-entitas (atom-atom, molekul-molekul, atau partikel-partikel lainnya) sejumlah jumlah atom-atom yang berada dalam 12 gram karbon-12. Nilai jumlah atom tersebut adalah 6,022×1023 yang disebut bilangan Avogadro, NA.Massa molar, }, didefinisikan sebagai massa dari 1 mol entitas (atom, ion, molekul, unit formula) dari materi. Satuan dari massa molar (}) adalah gram/mol.
 Materi Stoikiometri: Hubungan massa, jumlah mol, dan jumlah atom dari unsur
Materi Stoikiometri: Hubungan massa, jumlah mol, dan jumlah atom dari unsurRumus Empiris dan Rumus Molekuler
Rumus empiris merupakan rasio bilangan bulat paling sederhana dari jumlah mol dari masing-masing unsur dalam suatu senyawa. Rumus molekuler merupakan jumlah mol sebenarnya dari masing-masing unsur dalam 1 mol senyawa. Rumus molekuler bisa saja identik dengan rumus empiris ataupun merupakan kelipatan bilangan bulat dari rumus empiris. Sebagai contoh, asam fosfat (H3PO4) memiliki rumus molekuler dan rumus empiris yang identik. Glukosa memiliki rumus molekuler C6H12O6 yang merupakankelipatan 6 kali rumus empirisnya, CH2O.
rumus molekuler ≡ (rumus empiris)n
}rumus molekuler = n× }rumus empiris, n = 1, 2, 3, …
Dasar Stoikiometri Larutan
Istilah “konsentrasi” larutan menyatakan jumlah zat terlarut yang dilarutkan dalam sejumlah tertentu pelarut atau sejumlah tertentu larutan. Konsentrasi larutan dapat dinyatakan dalam molaritas. Molaritas (M) didefinisikan sebagai jumlah mol zat terlarut per liter larutan.Dasar Stoikiometri Gas Ideal
Volum molar, Vm, didefinisikan sebagai volum dari 1 mol entitas (atom, ion, molekul, unit formula) dari materi. Satuan dari volum molar (Vm) adalah L/mol.Pada keadaan RTP/ATP (P = 1 atm, T = 298 K), Vm gas ideal = 24 L/mol
Pada keadaan tertentu, berlaku hukum gas ideal:
Menulis dan Menyetarakan Persamaan Reaksi Kimia
Persamaan reaksi kimia adalah pernyataan yang ditulis dengan rumus molekuler yang memberikan informasi identitas dan kuantitas zat-zat yang terlibat dalam suatu perubahan kimia ataupun fisika. Semua zat yang bereaksi, disebut pereaksi/reaktan, ditempatkan di sebelah kiri tanda panah, yang arah panahnya ke kanan menunjuk pada produk, yakni semua zat yang dihasilkan dari reaksi.Dalam persamaan reaksi, dikenal koefisien reaksi, yaitu bilangan yang berada di sebelah kiri rumus molekuler untuk mengalikan semua atom dalam rumus molekuler tersebut. Perbandingan koefisien-koefisien reaksi dapat diinterpretasi sebagai perbandingan mol zat-zat dalam reaksi. Pada setiap reaktan dan produk, dituliskan wujud zatnya (s (padat), l (cair), g (gas), atau aq (larutan dengan pelarut air)) dalam tanda kurung di sebelah kanan rumus molekuler masing-masing.
Contoh persamaan reaksi kimia setara:

Contoh langkah-langkah menyetarakan persamaan reaksi:
1.

2.

3.

4.

Stoikiometri Reaksi
Dalam reaksi kimia, jumlah reaktan-reaktan yang bereaksi kadang tidak sesuai dengan jumlah stoikiometrik reaksi (tidak sesuai dengan perbandingan koefisien pada persamaan reaksi setara). Oleh karena itu, akan ada reaktan yang habis bereaksi terlebih dahulu dibanding reaktan lainnya. Reaktan yang masih tersisa setelah bereaksi disebut sebagai pereaksi berlebih. Reaktan yang habis duluan itu disebut sebagai pereaksi pembatas. Setelah pereaksi pembatas habis, tidak ada lagi produk reaksi yang terbentuk. Jadi, jumlah pereaksi pembatas menentukan jumlah produk yang dihasilkan.Contoh Soal Stoikiometri
Logam alkali (golongan 1) bereaksi dengan halogen (golongan 17) membentuk senyawa ionik logam halida. Berapa gram kalium klorida yang terbentuk dari reaksi 5,25 L gas klorin pada tekanan 0,950 atm dan temperatur 293 K dengan 17,0 g kalium?Jawab:







0 komentar:
Posting Komentar